Понятие об эквиваленте. Эквиваленты
веществ в реакциях разного типа. Способы выражения концентрации растворов.
Понятие об
эквиваленте
Любые химические взаимодействия можно записать с помощью химических реакций. Несмотря на многообразие химических реакций, все они протекают, подчиняясь определенным законам: закону сохранения массы веществ, закону кратных отношений, а также закону эквивалентов – одному из важнейших законов не только химии, но и всей человеческой жизни. Звучит он следующим образом:
Все вещества вступают в реакции в эквивалентных количествах.
В жизни мы постоянно сталкиваемся с законом эквивалентов, когда, например, совершаем покупки – за буханку Урожайного мы отдадим 14 руб, значит, 14 руб и буханка хлеба - эквивалентны. Правда, в разных городах стоимость Урожайного может быть различна, следовательно, величина эквивалента будет зависеть от условий, в которых происходит обмен.
Прежде чем дать определение химического эквивалента, вспомним, что в
химии принято использовать свои единицы измерения
количества вещества. Так, количество вещества принято выражать в молях. Понятие моля относится к тому же
ряду, что и понятия «тысяча», «миллион», «миллиард», но оно предназначено для подсчета еще большего числа частиц. Один
моль содержит 6,0 .1023 структурных элементов (атомов,
молекул, ионов, электронов или каких-либо других частиц). Столько атомов содержится
в
Масса 1 моль вещества называется молярной массой, она обозначается символом M и измеряется в г/моль. Молярная масса характеризует только чистые вещества, имеющие определенную химическую формулу. Численно молярная масса вещества равна его относительной молярной массе – безразмерной величине, которую легко вычислить по химической формуле вещества и таблице атомных масс, выраженных в атомных единицах массы. Так, для нахождения массы одного моля воды, формула которой Н2О, надо сложить атомные массы водорода и кислорода, причем атомную массу водорода надо умножить на 2 – по числу атомов, входящих в состав молекулы.
М = 2.1+16=18 г/моль. Следовательно, 1 моль воды равен 18 граммам.
Чтобы
узнать, сколько молей вещества содержится в некоторой его массе, надо разделить
массу вещества на его молярную массу. Например, вычислим, сколько молей воды
содержится в
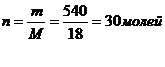
Эквивалент – та часть моля вещества,
которая взаимодействует (отдает или принимает) с 1 в.ч. водорода или с 8 в.ч. кислорода или вытесняет их в ходе реакции.
Таким образом, эквивалентом называют условную частицу, представляющую некоторую часть реальной молекулы (иона, атома).
Вычисления эквивалентов веществ разных классов проводят по следующим формулам:
- эквивалент кислоты- отношение молярной массы кислоты к числу атомов Н, входящих в состав молекулы: Э к-ты = М / к-во Н
- эквивалент оснований – отношение молярной массы основания к числу групп ОН-, входящих в состав молекулы: Э осн = М / к-во ОН
- эквивалент солей – отношение молярной массы соли к произведению числа атомов металла, входящих в состав соли, умноженное на валентность металла:
Э соли М/ (вал-сть Ме . к-во Ме)
- эквивалент оксидов – отношение молярной массы оксида к удвоенному числу атомов кислорода, входящих в состав молекулы: Э оксида = М / 2 О
Эквивалент вещества может меняться, в зависимости от условий протекания химической реакции. Какую именно часть молекулы (целую молекулу, половину, треть и т.п.) следует в данном случае считать одним эквивалентом - покажет уравнение химической реакции. Так, для кислотно-основных реакций эквивалент соответствует одному отдаваемому или принимаемому протону. Если в ходе реакции одна молекула Х отдает или принимает один или два протона, эквивалент Х условно составляет целую или ½ часть молекулы Х соответственно. Например, молярная масса эквивалента угольной кислоты может быть равна молярной массе H2CO3 или половине этой массы, в зависимости от того, сколько протонов отдает молекула H2CO3. Для реакции
H2CO3 + NaOH = NaHCO3 + H2O
эквивалент H2CO3 составляет целую молекулу, а для реакции
H2CO3 + 2 NaOH = Na2CO3 + 2H2O,
в которой
молекула H2CO3 отдает
два протона, эквивалент H2CO3 - «половина»
молекулы.
В общем случае, в реакции:
а Х + в В = с С + d D
одна частица Х эквивалентна b/a частицам B. Отношение b/a – называют фактор эквивалентности.
Упражнения. Вычислить молярную массу веществ: серная кислота, вода, гидроксид натрия, соляная кислота, сульфат натрия, гидроксид железа, хлорид натрия, карбонат натрия.
Составить
уравнения реакций:
- соляная кислота + гидроксид натрия: HCl + NaOH =
- серная кислота + 1 моль гидроксида натрия: H2SO4 + NaOH =
- серная кислота + 2 моля гидроксида натрия: H2SO4 + 2 NaOH =
- 2 моля гидроксида натрия + сульфат меди: NaOH +CuSO4 =
Расчет эквивалентов веществ.
Вычислить эквиваленты соляной, серной, фосфорной кислот, гидроксидов натрия, кальция, железа (3), карбоната натрия.
Эквиваленты веществ в реакциях
различного типа.
Попробуйте самостоятельно вычислить эквиваленты веществ в следующих реакциях:
Карбонат натрия + 1 моль соляной кислоты
Карбонат натрия + 2 моля соляной кислоты
Гидроксид натрия + 1 моль фосфорной кислоты
Гидроксид натрия + 2 моль фосфорной кислоты
Гидроксид натрия + 3 моль фосфорной кислоты
Способы выражения концентрации растворов
В ходе анализа рассчитывают концентрации, то есть количества веществ в определенном объеме (V) раствора. Существует несколько способов выражения концентраций растворов.
Массовая доля
Состав растворов и других объектов сложного состава часто характеризуют долями компонентов, в частности, массовыми долями. Массовая доля (w ) - отношение массы Х к суммарной массе всех компонентов, то есть к массе растовра (пробы)пробы
w
= mX / S m .
Массовую долю часто выражают в %, принимая массу пробы за 100%. В этом случае ее называют процентной концентрацией (w, %). Численно она равна числу граммов растворенного вещества, содержащегося в 100 граммах раствора.
Процентные концентрации можно использовать для характеристики раствора даже в тех случаях, когда молярная масса растворенного вещества неизвестна или когда растворенное вещество является смесью разных компонентов. Очень низкие массовые доли (процентные содержания микропримесей) иногда выражают в особых единицах – частях на миллион (ppm), частях на миллиард (ppb) и частях на триллион (ppt).
1 ppm = 10-6 = 10-4 %; 1 ppb = 10-9 = 10-7 % , 1 ppt = 10-12 = 10-10 %
Упражнение
Сколько г. хлорида натрия следует взять для приготовления 200 г 5%-го раствора.
Молярная концентрация
Отношение числа молей растворенного вещества к объему раствора называют молярной концентрацией, ее обозначают
символом С и
измеряют в моль/дм3. Очевидно, С
= n / V. Так как 1 дм3 в точности равен 1 литру,
концентрацию раствора можно выражать и в моль/л. Эту единицу иногда сокращенно обозначают
символом М. Часто в растворе содержится сразу несколько растворенных веществ,
поэтому, записывая молярную концентрацию, желательно указывать в скобках те
частицы, количество которых характеризуют. Так, запись С(С2H5OH) =
Массу растворенного вещества, m, в некотором объеме раствора (V), с молярной концентрацией С, можно найти по формуле:
m=C.V.M,
где М- молярная масса вещества.
Если объем выражен в литрах, то вычисленная масса будет выражена в граммах, если в миллилитрах – то масса – в миллиграммах.
Упражнения
Сколько г. гидроксида натрия следует взять для приготовления 1 литра 0,1 М раствора
Сколько г. хлорида натрия следует взять для приготовления 0,25 литра 0,05 М раствора
Сколько г. щавелевой кислоты следует взять для приготовления 0,2 литра 0,01 М раствора
Нормальная (молярная
концентрация эквивалента)
В химических методах предпочтительнее пользоваться
концентрациями, характеризующими число молей эквивалентов растворенного вещества,
содержащегося в 1 литре раствора. Молярные концентрации, выраженные таким образом,
нередко называют нормальными, и
обозначают как Сн или N, хотя международные
объединения химиков теперь не рекомендуют использовать этот термин. Запись С (1/5 КMnO4) =
Поскольку
эквивалент вещества зависит от того, какая протекает реакция, то и нормальная
концентрация одного и того же раствора может быть различна. Например, концентрация угольной кислоты, выраженная числом
молей эквивалентов H2CO3
в литре раствора (нормальная концентрация),
может быть либо равной молярной концентрации H2CO3 , либо вдвое большей величиной. Есть полезное
правило:
нормальная концентрация раствора Х
либо равна молярной, либо в k раз
больше, где k - число
протонов (электронов), которое отдает или принимает одна молекула Х в данной реакции.
Кроме молярных и нормальных, существуют и другие
виды концентраций
Титр , или массовая концентрация равна отношению массы растворенного вещества к объему раствора, она измеряется в кг/дм3 (или кг/л). Допускается выражать массовую концентрацию в других единицах: г/л, мг/л, мкг/л, мкг/мл.
Молярные и процентные концентрации однотипных растворов приблизительно пропорциональны друг другу. Пересчитывать одни концентрации в другие в ходе выполнения анализа приходится довольно часто, и для пересчета удобно пользоваться формулами:
С = 10 rw% / M
w% = CM / 10 r
где r - плотность
раствора, выраженная в кг/дм3 или, что то же самое, в г/мл. Для разбавленных водных
растворов величину r можно считать
приблизительно равной единице.