Химические
методы анализа
Все химические методы анализа основаны на добавлении к исследуемой пробе специально выбранного реагента R. Обычно пробу заранее переводят в раствор, создают подходящие условия для реакции (рН, температура и т.п.), добавляют вспомогательные реагенты (маскирующие вещества, индикаторы и др.), а затем вводят раствор основного реагента R. Его подбирают так, чтобы он взаимодействовал с определяемым компонентом (Х) и, по возможности, не реагировал с другими компонентами пробы. Если символом Y обозначить продукты реакции, любой химический метод будет соответствовать общей схеме:
X + R ![]() Y
Y
К группе химических относят, прежде всего, три «классических» метода –
-качественный анализ растворов с применением групповых реагентов и реакций обнаружения
-гравиметрический (весовой) анализ
-титриметрический (объемный) анализ - самый важный из всех химических методов/
Классические методы в свое время сыграли основную роль при установлении состава природных веществ, с их помощью была установлена атомно-молекулярная структура веществ, открыты основные химические законы. Классические методы и сегодня используют в контрольно-аналитических лабораториях, хотя реже, чем раньше. К числу химических относят также кинетические, ферментативные и иммунохимические методы, газоволюмометрический анализ и некоторые другие методы, имеющие ограниченное применение.
Разумеется, химические реакции используют и в электрохимических, оптических, термических и других методах, широко применяемых на практике. Но в этих случаях в ходе реакции или после ее окончания измеряют какое-то физическое свойство исследуемой системы, применяя соответствующие измерительные приборы, а не только аналитические весы и мерную посуду, как в классических методах. Поэтому перечисленные выше методы нередко выделяют в особую группу физико-химических методов. Эти методы рассматриваются в главе 6 вместе с чисто физическими методами, не связанными с химическими реакциями.
Реакции, используемые в анализе
Аналитические реакции и требования к ним. Химические методы анализа основаны на проведении химической реакции между определяемым веществом Х и каким-либо реагентом R. Такие реакции часто называют аналитическими. Все они соответствуют общей схеме:
Х + R ![]() Y
Y
и должны отвечать ряду общих требований:
- проходить при комнатной температуре и атмосферном давлении;
- протекать с большой скоростью. Желательно, чтобы равновесие устанавливалось как можно быстрее – за несколько секунд или, в крайнем случае, за несколько минут;
- при установившемся равновесии степень превращения реагирующих веществ должна быть достаточно высокой. Желательно, чтобы реакция проходила количественно, со 100-процентным выходом продуктов (Y);
- реакция должна соответствовать определенному стехиометрическому уравнению.
Невыполнение любого из этих требований может привести к ошибочным результатам анализа, поэтому реакции, не обладающие перечисленными свойствами, в анализе практически не используют. Кроме общих требований к аналитическим реакциям, в рамках отдельных методов существуют дополнительные требования к реакциям или их продуктам, не имеющие общего характера. Например, в фотометрическом анализе реакция должна приводить к образованию веществ, сильно поглощающих свет, в гравиметрическом анализе – к образованию малорастворимых или летучих веществ. В качественном анализе для обнаружения Х можно применять только те реакции, которые дают заметный внешний эффект (образование осадков, появление или изменение окраски раствора и т.п.), а для титриметрического определения Х это условие вовсе не обязательно.
С учетом вышеизложенных требований в химических методах анализа преимущественно применяют реакции следующих типов:
·
кислотно-основные,
·
окислительно-восстановительные,
·
реакции
комплексообразования.
·
осаждения
(осадки можно получать, проводя реакции
любого типа, например кислотно-основные или окислительно-восстановительные)
Кроме перечисленных выше реакций, в анализе иногда применяют и некоторые другие, в частности, отдельные реакции органического синтеза. В последние годы важную роль стали играть характерные для живого организма реакции с участием ферментов.
Как правило, аналитические реакции проводят в растворах. В качестве растворителя используют воду, а также другие жидкости, например, спирты, карбоновые кислоты, кетоны.
Все аналитические реакции в той или иной степени обратимы. Чтобы равновесие реакции было смещено в сторону образования продуктов, надо выбирать подходящие реагенты. Нужно также создавать такие условия проведения реакции, которые обеспечат ее протекание с требуемой полнотой, с количественным образованием продуктов. Находить подходящие условия можно эмпирически, «методом проб и ошибок», но гораздо быстрее и проще делать это расчетным путем.
Химические
методы качественного анализа
Задачи качественного анализа и способы его проведения. Основная цель качественного анализа – получение информации о том, какие именно компоненты входят в состав исследуемой пробы. В ходе элементного качественного анализа выясняют, какие элементы входят в состав пробы. В ходе вещественного анализа выясняют, в какой степени окисления присутствует каждый элемент, какие именно ионы он образует в растворе. Можно проверять наличие в пробе тех или иных молекул (молекулярный качественный анализ). Важная задача - проверка присутствия молекул, имеющих заданные функциональные группы и другие заданные структурные элементы (структурно-групповой, или функциональный, анализ).
Результатом
качественного анализа должна стать идентификация
всех или некоторых компонентов исследуемого объекта, а иногда и отнесение
самого этого объекта к определенному классу объектов. Компонент (или объект в
целом) считают идентифицированным (опознанным
с требуемой надежностью), если при исследовании пробы будут обнаружены признаки
присутствия искомого компонента, его характеристические свойства, совпадающие
со свойствами эталона.
Химические методы количественного
анализа.
Гравиметрический анализ
История и принцип метода. Гравиметрия - классический метод количественного химического анализа, который используется с давних времен. До середины XX века его называли весовым анализом, поскольку метод основан на взвешивании. Аналитическим сигналом в этом методе является масса вещества; как правило - масса некоторого продукта химической реакции.
Р.Бойль в конце XVII века стал разделять исследуемые вещества до далее не разложимых составных частей (он называл их элементами), а затем взвешивал их. По результатам взвешивания можно было рассчитать относительное содержание элемента в исходной пробе. Например, содержание золота или воды, которую Бойль тоже считал элементом. Но такой вариант весового анализа (метод выделения) возможен далеко не всегда. В конце XVIII века были разработаны другие варианты – метод осаждения (его создал шведский ученый Т.Бергман для анализа минералов) и метод отгонки, предложенный знаменитым французским химиком А.Лавуазье для анализа органических веществ. В обоих случаях искомый элемент выделяли и взвешивали не в свободном виде, а в виде некоторого соединения точно известного состава.
В начальный период развития химии гравиметрия была основным способом количественного анализа. Именно гравиметрическим методом химики получали экспериментальные данные, на основании которых на рубеже XVIII и XIX веков были созданы основные законы химии. В частности, закон сохранения суммарной массы веществ в ходе химических реакций (А.Лавуазье), закон эквивалентов (И.Рихтер), закон постоянства состава (Ж.Пруст) и другие. Результаты огромного множества анализов, выполненных гравиметрическим методом, позволили установить количественный состав и химические формулы всевозможных веществ, а также определить атомные массы большинства элементов (Й.Я.Берцелиус). Гравиметрию использовали и в качестве способа аналитического контроля в промышленности, хотя такому ее применению всегда мешала длительность и трудоемкость соответствующих методик анализа.
Еще в первой половине XIX века развитие теоретических основ и техники гравиметрического анализа привело к значительному повышению его точности. Этому также способствовало совершенствование аналитических весов. Абсолютная погрешность взвешивания снизилась до 0,0001 г, а в отдельных случаях – еще на 1-2 порядка. В настоящее время гравиметрия является одним из самых точных (правильных и воспроизводимых) методов количественного анализа. Нередко относительная погрешность результата анализа не больше 0,01 %. Предотвратить систематические погрешности помогает хорошо развитая теория метода.
Гравиметрия - универсальный метод, пригодный и для элементного, и для молекулярного, и для фазового анализа. Но практическое применение этого метода в настоящее время сократилось. Теперь так проводят анализы, если необходима высокая точность результатов, а длительность и трудоемкость методик не имеют принципиального значения. Гравиметрию используют для точного определения основных компонентов и важнейших примесей (содержание которых >0,1 %) в минералах, почвах, органических веществах, нефтепродуктах, химических реактивах и других объектах. Гравиметрическим методом выполняют особо ответственные анализы (арбитраж, определение драгоценных металлов), определяют состав стандартных образцов химического состава, стандартизуют исходные растворы для других, менее точных методов (титриметрия, фотометрия) или в ходе научных исследований.
Существуют три основных варианта гравиметрии: методы выделения, методы отгонки и методы осаждения. Последняя группа методов имеет наибольшую практическую значимость.
Методы выделения и методы отгонки. В методах выделения пробу переводят в раствор, из которого выделяют определяемый элемент в свободном виде, в виде осадка простого вещества. Примером может быть методика анализа горных пород, в которой золото переводят в солянокислый раствор (там оно существует в форме [AuCl4]-), а затем восстанавливают:
2[AuCl4]-
+ 3H2O2 = 2Au↓ + 3O2↑ +
8Cl- + 6H+
Осадок отфильтровывают, высушивают и взвешивают.
Другой пример – определение серебра, меди и некоторых других металлов. Их соединения восстанавливают электрическим током на платиновом катоде
Cu2+ + 2 e = Cu ↓
Этот вариант гравиметрии, получил особое название - электрогравиметрический анализ.
Методы отгонки включают термообработку пробы и/или обработку ее кислотами. В результате определяемый компонент превращается в какое-либо летучее соединение (химическая реакция в данном случае не обязательна). В прямых методах массу этого соединения находят по привесу сосуда, содержащего поглотитель, т.е. реагент, взаимодействующий с улавливаемым летучим соединением. Так, для определения карбонатов их переводят в углекислый газ, который отгоняют, а затем поглощают натронной известью (смесь NaOH и CaO). Прямые методы применяют также при определении фтора, мышьяка и некоторых других элементов. Тот же принцип лежит в основе важнейшего метода элементного анализа органических соединений, так называемого СН-анализа. Навеску вещества сжигают в токе кислорода (иногда с добавкой других окислителей и специальных катализаторов). Продукты сгорания поступают в последовательно расположенные поглотительные трубки. В одной из них количественно и селективно поглощается образовавшийся углекислый газ. В другой, содержащей Mg(ClO4)2, поглощается вода. Массу углерода и водорода в исходной навеске рассчитывают по привесу соответствующих поглотителей.
Косвенные методы основаны на измерении убыли массы пробы после отгонки летучего компонента. Например, взвешивая пробу до и после нагревания при определенной температуре, определяют влажность почвы, кристаллизационную воду в кристаллогидратах, фракционный состав и зольность нефти.
Методы осаждения. В этом случае методика анализа включает следующие операции:
· взвешивание пробы (взятие навески);
· растворение навески;
· добавление избытка осадителя (получение осаждаемой формы определяемого вещества Х);
· промывание и фильтрование полученного осадка;
· высушивание или прокаливание этого осадка (перевод аналита в гравиметрическую форму);
· взвешивание гравиметрической формы.
Выполнение всех операций должно обеспечивать количественное (т.е. не сопровождающееся потерями) превращение определяемого компонента в гравиметрическую форму. Полноту осаждения Х и полноту удаления примесей из осадка при его промывании проверяют с помощью подходящих качественных реакций. Промытый на фильтре осадок высушивают или прокаливают вместе с фильтром до тех пор, пока масса не перестанет уменьшаться. Доведение до постоянной массы свидетельствует о полном удалении воды и летучих примесей, а в случае прокаливания - полноту сгорания фильтра и полноту перевода Х в гравиметрическую форму.
Гравиметрическое определение некоторых ионов можно представить такими схемами:
+ NH3 t
![]()
![]() Fe3+ Fe(OH)3 Fe2O3
Fe3+ Fe(OH)3 Fe2O3
+ BaCl2 t
![]()
![]() SO42– BaSO4 BaSO4
SO42– BaSO4 BaSO4
+ NH4H2PO4 t
![]()
![]() Mg2+ NH4MgPO4 Mg2P2O7
Mg2+ NH4MgPO4 Mg2P2O7
определяемый осаждаемая гравиметрическая
компонент форма форма
Расчет результата анализа. Аналитический сигнал в гравиметрии – это измеренная на аналитических весах масса получаемой в ходе данного анализа гравиметрической формы определяемого вещества - m(ГФ). Независимо от того, какой вариант анализа используют в том или ином случае, результаты рассчитывают с помощью гравиметрического фактора F. Это масса определяемого вещества, точно соответствующая одному грамму гравиметрической формы. Если молярная масса гравиметрической формы равна М (ГФ), а определяемого вещества - М(Х), то величину F рассчитывают по формуле:
![]() (4.3).
(4.3).
При этом учитывают стехиометрию реакции осаждении. Берут такие коэффициенты a и b, чтобы уравнять количества атомов элемента Х в определяемом веществе и в гравиметрической форме. Например, при определении железа в виде Fe2O3 фактор рассчитывают по формуле:
![]()
![]()
Точность вычисления величины F и результата анализа должна соответствовать точности взвешивания, поэтому расчет ведут с использованием как можно более точных значений молярных масс. Их выражают числами, содержащих не менее четырех значащих цифр. Такой же должна быть и величина F. Для распространенных методик гравиметрического анализа величину фактора F можно найти и в справочниках. Зная F, можно рассчитать результат анализа – массовую долю определяемого компонента Х в анализируемой пробе – по формуле:
![]()
Выбор осадителя. Реагенты-осадители выбирают с учетом свойств определяемого вещества и состава пробы. Учитывают и свойства осаждаемой и гравиметрической форм, которые можно получить с применением каждого возможного осадителя.
Требования к осаждаемой форме:
1. Селективность действия осадителя. Если это требование не выполняется, то есть в осадок может перейти не только определяемый компонент, но и другие компоненты пробы, то для получения правильного результата анализа придется маскировать либо предварительно удалять мешающие вещества, а также регулировать величину рН в процессе осаждения.
2. Полнота осаждения. Допустимая концентрация Х в растворе над осадком должна быть не более 10-6 моль/л. В этом случае потери Х за счет неполного осаждения не превысят 0,0002 г - обычную погрешность взвешивания на аналитических весах. Столь малыми потерями можно пренебречь.
3. Быстрое отделение осадка от раствора. Осадки легко фильтруются, если они образуются в крупнокристаллической форме. Аморфные осадки также стараются получить в плотной, компактной форме. Для образования осадков с такими свойствами необходимо создавать специальные условия их получения.
4. Осадок должен быть чистым, то есть не должен содержать никаких примесей, либо примеси должны легко удаляться при промывании и прокаливании. Основной примесью обычно является избыточный осадитель, поэтому в качестве осадителей следует использовать те соединения, которые при прокаливании легко разлагаются и полностью удаляются.
5. Осадок должен количественно, без
потерь, превращаться в гравиметрическую форму постоянного состава. Поэтому
нельзя применять осадки, вступающие в химические реакции с углеродом,
образующимся при обугливании бумажного фильтра при прокаливании осадка.
Фильтрование, промывание и прокаливание осадков с сильными окислительными
свойствами проводят с использованием стеклянных фильтрующих тиглей.
Требования к гравиметрической форме:
1. Постоянный состав, строго соответствующий определенной химической формуле. Так, в качестве гравиметрической формы не могут быть использованы гидроксиды металлов, содержащие неопределенное количество воды, и другие соединения переменного состава.
2. Химическая устойчивость по отношению к кислороду воздуха и водяным парам. Если гравиметрическая форма не отвечает этому требованию (например, CaO), ее взвешивают в плотно закрытом тигле, а охлаждают в эксикаторе, содержащем вещества, поглощающие воду.
3. Как можно большая величина молярной массы (т. е. как можно меньшая величина гравиметрического фактора F, см. ниже). В этом случае погрешность результата анализа уменьшится. Например, определение фосфора можно вести, получая разные гравиметрические формы: Mg2P2O7 (F=0,2783) или (NH4)3PO4.12МоО3 (F=0,01639). При прочих одинаковых условиях (например, при той же погрешности взвешивания) погрешность определения фосфора по второй методике окажется приблизительно в 17 раз меньше, чем по первой.
Понятно, почему в качестве осадителя часто используют органические вещества с большой молярной массой. Этот способ дает весьма чистые крупнокристаллические осадки. Органические осадители более селективны, чем неорганические.
Выбор условий анализа.
1. Расчет массы исходной навески. При слишком малой навеске пробы аналитик не сумеет добиться необходимой точности, при слишком большой – потратит слишком много времени на проведение анализа. Эмпирически установлено, что оптимальная масса гравиметрической формы при получении кристаллического осадка составляет ≈ 0,5 г, при получении аморфного осадка ≈ 0,1 г. Чтобы рассчитать оптимальную навеску (mпробы) по формуле (4.4), необходимо заранее знать v - содержание определяемого компонента, хотя бы примерно.
2. Расчет необходимого количества осадителя. Такой расчет ведут по уравнению реакции; при этом, как и в предыдущем случае, надо знать ориентировочное содержание Х в пробе, а также массу исходной навески. Для обеспечения полноты осаждения обычно используют полуторакратный избыток осадителя по сравнению со стехиометрическим его количеством.
3. Оценка полноты осаждения и потерь осадка при его получении и промывании. Осаждение можно считать полным, а потери, не превышающими допустимого уровня, если масса потерянной гравиметрической формы не превышает погрешности взвешивания на аналитических весах (10-4 г). Потери рассчитывают, исходя из растворимости осаждаемой формы (S, моль/л), объема раствора (V, л), из которого проводили осаждение, и объема промывных вод. Учитывают также молярную массу гравиметрической формы, то есть величину M(ГФ)
m(потерь) = M(ГФ) S V
4. Выбор температуры высушивания или прокаливания осадка. При разработке методик гравиметрического анализа исследуют зависимость массы осадка от изменяющейся температуры. Для этого используют специальные приборы (термовесы или дериватографы), которые автоматически записывают термогравиметрические кривые в координатах m = f (T). В качестве примера на рис. 1приведена кривая, зарегистрированная при постепенном высушивании и прокаливании осадка (кристаллогидрата оксалата кальция). Горизонтальные участки указывают на области существования разных соединений кальция, которые последовательно превращаются друг в друга при нагревании (СаС2O4, СаСO3 , СаO). Изломы на кривой соответствуют температурам, при которых идет превращение одной формы в другую. Любое из этих соединений может быть выбрано в качестве гравиметрической формы, тогда температуру прокаливания осадка выбирают в пределах соответствующего горизонтального участка.
m t, ![]()
![]()
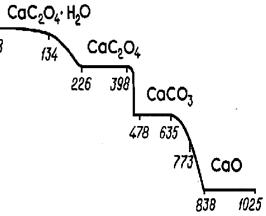
Рис.1. Термогравиметрическая кривая разложения навески оксалата кальция
6. Весьма важно правильно выбрать концентрацию раствора осадителя, скорость его прибавления к анализируемому раствору, а также температуру раствора при осаждении. Соответствующие рекомендации различны для методик, связанных с получением крупнокристаллических и аморфных осадков. А именно,
· кристаллические осадки следует получать, медленно добавляя горячий разбавленный раствор осадителя к горячему разбавленному раствору пробы. Полученный осадок перед фильтрованием рекомендуется выдерживать несколько часов в маточном растворе.
· аморфные осадки следует получать из концентрированных горячих растворов, быстро смешивая их и сразу же отфильтровывая получаемый осадок.
Эти правила позволяет получать более точные результаты анализа.