Титриметрический анализ
История
и принцип метода
Титриметрический анализ (титриметрия) - важнейший из химических методов анализа. Он возник в XVIII веке, вначале как эмпирический способ проверки качества различных материалов, например, уксуса, соды, отбеливающих растворов. На рубеже XVIII и XIX веков были изобретены бюретки и пипетки (Ф.Декруазиль). Особое значение имели труды Ж.Гей-Люссака, который ввел основные термины этого метода: титрование, титрант и другие, происходящие от слова «титр». Титр – это масса растворенного вещества (в граммах), содержащаяся в одном миллилитре раствора. Во времена Гей-Люссака результаты анализа вычисляли именно с помощью титров. Однако титр как способ выражения концентрации раствора оказался менее удобным, чем другие характеристики (например, молярные концентрации), поэтому в современной аналитике химии расчеты с применением титров ведут довольно редко. Напротив, различные термины, произведенные от слова «титр», применяют очень широко.
В середине XIX века немецкий химик К.Мор обобщил все созданные к тому времени титриметрические методики и показал, что в основе любой методики лежит один и тот же принцип. К раствору пробы, содержащей определяемый компонент Х, всегда прибавляют раствор с точно известной концентрацией реагента R (титрант). Этот процесс и называют титрованием. Проводя титрование, аналитик следит за протеканием химической реакции между Х и добавляемым R. По достижении точки эквивалентности (т.экв.), когда число молей эквивалентов введенного R точно сравняется с числом молей эквивалентов находившегося в пробе вещества Х, титрование прекращают и измеряют объем затраченного титранта. Момент окончания титрования называют конечной точкой титрования (к.т.т.), ее, как и т.экв., выражают в единицах объема, обычно в миллилитрах. В идеальном случае Vк.т.т = Vт.экв., но на практике точное совпадение по разным причинам не достигается, титрование заканчивают чуть раньше или, наоборот, чуть позже, чем будет достигнута т.экв. Естественно, титрование следует проводить так, чтобы различие между Vт.экв. и Vк.т.т. было бы как можно меньшим.
Поскольку массу или концентрацию Х рассчитывают по объему титранта, затраченному на титрование пробы (по Vк.т.т.), в прошлом титриметрию называли объемным анализом. Это название нередко используют и сегодня, но термин титриметрический анализ более точен. Дело в том, что операция постепенного прибавления реагента (титрование) характерна для любой методики этого типа, а расход титранта можно оценивать не только путем измерения объема, но и другими способами. Иногда добавляемый титрант взвешивают (измерение массы на аналитических весах дает меньшую относительную погрешность, чем измерение объема). Иногда измеряют время, за которое будет введен титрант (при постоянной скорости ввода).
С конца XIX века титриметрические методики стали применять и в исследовательских, и в заводских, и в других лабораториях. С помощью нового метода оказалось возможным определять миллиграммовые и даже микрограммовые количества самых разных веществ. Широкому использованию титриметрии способствовали простота метода, невысокая стоимость и универсальность оборудования. Особенно широко титриметрию стали применять в 50-х годах XX века, после создания швейцарским аналитиком Г.Шварценбахом нового варианта этого метода (комплексонометрии). Одновременно началось широкое применение инструментальных методов контроля к.т.т. К концу 20 века значение титриметрии несколько снизилось в связи с конкуренцией более чувствительных инструментальных методов, но и сегодня титриметрия остается очень важным методом анализа. Она позволяет быстро, легко и достаточно точно определять содержание большинства химических элементов, отдельные органические и неорганические вещества, суммарное содержание однотипных веществ, а также обобщенные показатели состава (жесткость воды, жирность молока, кислотность нефтепродуктов).
Техника проведения титриметрического анализа
Принцип метода станет более понятен после изложения техники его проведения. Итак, пусть Вам принесли раствор щелочи неизвестной концентрации, и Ваша задача – установить его точную концентрацию. Для этого Вам понадобится раствор регента, или титранта – вещества, которое вступает в химическую реакцию со щелочью, причем концентрация титранта должна быть точно известна. Очевидно, что для установления концентрации щелочи в качестве титранта используем раствор кислоты.
1. Отбираем с помощью пипетки точный объем анализируемого раствора – он называется аликвота. Как правило, объем аликвоты составляет 10-25 мл.
2. Переносим аликвоту в колбу для титрования, разбавляем водой и добавляем индикатор.
3. Заполняем бюретку раствором титранта и выполняем тирование – медленное, по каплям, добавление титранта к аликвоте исследуемого раствора.
4. Заканчиваем титрование в момент, когда индикатор изменит свою окраску. Этот момент называется конечной точкой титрования – к.т.т. К.т.т., как правило, совпадает с моментом, когда реакция между определяемым веществом и титрантом закончена, т.е. к аликвоте добавлено точно эквивалентное количество титранта – этот момент называется точкой эквивалентности, т.э. Таким образом т.э. и к.т.т. – это две характеристики одного и того же момента, одна – теоретическая, другая – экспериментальная, зависящая от выбранного индикатора. Поэтому надо правильно выбирать индикатор, с тем, чтобы к.т.т. как можно точнее совпадала с т.э.
5. Измеряют объем титранта, пошедшего на титрование, и вычисляют концентрацию исследуемого раствора.
Виды
титриметрического анализа
Классифицировать титриметрические методики можно по нескольким независимым признакам: а именно: 1) по типу реакции между Х и R, 2) по способу проведения титрования и расчета результатов, 3) по способу контроля т.экв.
Классификация по типу химической реакции – наиболее важная. Напомним, что далеко не все химические реакции можно использовать для проведения титрований.
Во-первых, как и в других химических методах, определяемый компонент (аналит) должен количественно реагировать с титрантом.
Во-вторых, надо, чтобы равновесие реакции устанавливалось как можно быстрее. Реакции, в которых после добавления очередной порции титранта установление равновесия требует хотя бы нескольких минут, в титриметрии применять затруднительно или вообще невозможно.
В-третьих, реакция должна отвечать единственному и заранее известному стехиометрическому уравнению. Если реакция ведет к смеси продуктов, состав этой смеси будет меняться в ходе титрования и зависеть от условий проведения реакции. Зафиксировать точку эквивалентности будет очень трудно, а результат анализа окажется неточным. Совокупности указанных требований отвечают реакции протолиза (нейтрализации), многие реакции комплексообразования и окисления-восстановления, а также некоторые реакции осаждения. Соответственно в титриметрическом анализе выделяют:
-метод нейтрализации,
-комплексометрию,
-редоксметрические методы
-методы осаждения.
Внутри каждого метода выделяют отдельные его варианты (табл.1). Их названия происходят от наименований реагентов, используемых в каждом из вариантов в качестве титранта (перманганатометрия, иодометрия, хроматометрия и т.п.).
Таблица 1.
Классификация титриметрических методик по
типу используемой химической реакции
|
Реакция |
Метод |
Реагент (титрант) |
Вариант метода |
Определяемые вещества |
|
Протолиз |
Метод нейтрализации |
НCl, HClO4, HNO3 |
Ацидиметрия |
Ocнования |
|
KOH, NaOH и др. |
Алкалиметрия |
Кислоты |
||
|
Комплексо-образование |
Комплексо-метрия |
ЭДТА |
Комплексонометрия |
Металлы и их
соединения |
|
NaF KCN |
Фторидометрия, цианидометрия |
Некоторые металлы, органические вещества |
||
|
Окисление-восстанов- ление |
Редокс-
метрия |
KMnO4 К2Сr2O7 |
Перманганатометрия хроматометрия |
Восстановители |
|
KJ и Na2S2O3 |
Иодометрия |
Восстановители,
окислители, кислоты |
||
|
Аскорбиновая кислота |
Аскорбинометрия |
Окислители |
||
|
Осаждение |
Седиметрия |
AgNO3 |
Аргентометрия |
Галогениды |
|
Hg2(NO3)2 |
Меркуриметрия |
|||
|
KSCN |
Роданометрия |
Некоторые металлы |
||
|
Ba(NO3)2 |
Бариеметрия |
Сульфаты |
Классификация по способу титрования. Обычно выделяют три способа: прямое, обратное и заместительное титрование. Прямое титрование предполагает непосредственное прибавление титранта к раствору пробы. Иногда применяют другой порядок смешивания реагентов – к известному количеству R постепенно добавляют раствор пробы, в котором хотят определить концентрацию Х; но это тоже прямое титрование. В обоих случаях расчет результатов анализа ведут по одним и тем же формулам, основанным на законе эквивалентов.
νХ = νR
где νХ и νR – количества молей эквивалентов Х и R. Расчетные формулы, основанные на соотношении , а также примеры расчетов будут даны ниже.
Прямое титрование - удобный и самый распространенный вариант титриметрии. Он более точен, чем другие. Ведь случайные погрешности в основном возникают при измерении объема растворов, а в данном способе титрования объем измеряют только один раз. Однако прямое титрование возможно далеко не всегда. Многие реакции между Х и R идут недостаточно быстро, и после добавления очередной порции титранта в растворе не успевает установиться равновесие. Иногда прямое титрование невозможно из-за побочных реакций или ввиду отсутствия подходящего индикатора. В подобных случаях применяют более сложные схемы обратного или заместительного титрования. Они включают не менее двух химических реакций.
Обратное титрование проводят по двухстадийной схеме:
Х + R1 =
Y1
R1 + R2 = Y2
Вспомогательный реагент R1 вводят в точно известном количестве. Объем и концентрацию раствора R1 выбирают так, чтобы R1 после завершения реакции с Х остался в избытке. Затем непрореагировавшую часть R1 оттитровывают титрантом R2. Примером может быть перманганатометрическое титрование органических веществ. Титровать многие вещества перманганатом «напрямую» не удается из-за замедленности их окисления и по другим причинам. Но можно сначала добавить к анализируемой пробе известное (избыточное) количество KMnO4, подкислить и нагреть полученный раствор. Это приведет к полному и быстрому завершению окисления органических веществ. Затем оттитровывают оставшийся перманганат каким-либо активным восстановителем, например, раствором SnCl2 или FeSO4.
Расчет результатов обратного титрования проводят, исходя из очевидного соотношения:
νХ = νR1 - νR2
Поскольку объемы в данном случае измеряют два раза (сначала объем раствора реагента R1, затем объем титранта R2), случайная погрешность результата анализа несколько выше, чем при прямом титровании. Особенно сильно возрастает относительная погрешность анализа при малом избытке вспомогательного реагента, когда νR1 ≈ νR2 .
Классификация по способу контроля т.экв. Известно несколько таких способов. Cамый простой - безындикаторное титрование, самый распространенный – титрование с цветными индикаторами, а самые точные и чувствительные – инструментальные варианты титриметрии.
Безындикаторное титрование основано на применении реакций, которые сопровождаются изменением видимых свойств титруемого раствора. Как правило, один из реагентов (Х или R) имеет видимую окраску. Ход такой реакции контролируют без специальных приборов и без добавления реактивов-индикаторов. Так, бесцветные восстановители титруют в кислой среде фиолетовым раствором окислителя – перманганата калия (KMnO4). Каждая порция добавляемого титранта будет сразу же обесцвечиваться, превращаясь под действием восстановителя в ионы Mn2+. Так будет продолжаться вплоть до т.экв. Однако первая же «лишняя» капля титранта окрасит титруемый раствор в розово-фиолетовый цвет, окраска не исчезнет и при перемешивании раствора. При появлении неисчезающей окраски титрование прекращают и измеряют объем затраченного титранта (Vк.т.т.). Конец титрования можно зафиксировать не только по появлению окраски титруемого раствора, как в рассмотренном примере, но и по обесцвечиванию ранее окрашенного раствора пробы, а также по появлению какого-либо осадка, его исчезновению или изменению внешнего вида. Безындикаторное титрование применяют довольно редко, так как лишь немногие реакции сопровождаются изменением видимых свойств раствора.
Инструментальное титрование. За протеканием реакции между Х и R можно следить не просто «на глаз» (визуально), но и с помощью приборов, измеряющих некоторое физическое свойство раствора. Варианты инструментальной титриметрии различают, смотря по тому, какое именно свойство раствора контролируется. Можно использовать любое свойство, зависящее от качественного и количественного состава титруемого раствора. А именно, можно измерять электропроводность раствора (этот вариант называют кондуктометрическим титрованием), потенциал индикаторного электрода, опущенного в титруемый раствор (потенциометрическое титрование), поглощение света титруемым раствором (фотометрическое титрование) и т.п. Прекратить титрование можно тогда, когда будет достигнуто некоторое заранее выбранное значение измеряемого свойства. Например, титруют раствор кислоты щелочью до тех пор, пока не будет достигнуто значение рН = 7. Однако чаще поступают по-другому - выбранное свойство раствора многократно (или даже непрерывно) измеряют по мере ввода титранта, причем не только до, но и после ожидаемой т.экв. По полученным данным строят графическую зависимость измеренного свойства от объема добавленного титранта (кривую титрования). Вблизи точки эквивалентности наблюдается резкое изменение состава и свойств титруемого раствора, а на кривой титрования регистрируется скачок или излом. Например, скачок потенциала электрода, опущенного в раствор. Положение т.экв оценивают по положению перегиба на кривой. Такой вариант анализа более трудоемок и длителен, чем обычное титрование, но дает более точные результаты. За одно титрование удается определить по отдельности концентрации целого ряда компонентов .
Известно более десятка вариантов инструментальной титриметрии. В создании их важную роль сыграл американский аналитик И.Кольтгоф. Соответствующие методики различаются по измеряемому свойству раствора, по используемой аппаратуре и по аналитическим возможностям, но все они чувствительнее и селективнее, чем индикаторные или безындикаторные визуальные варианты титриметрии. Инструментальный контроль особенно важен, когда нельзя применять индикаторы, например, при анализе мутных или интенсивно окрашенных растворов, а также при определении микропримесей и при анализе смесей. Однако инструментальная титриметрия требует оснащения лаборатории специальными приборами, желательно - самопишущими или полностью автоматизированными, что не всегда экономически целесообразно. Во многих случаях достаточно точные и надежные результаты могут быть получены более простым и дешевым способом, основанным на применении индикаторов.
Использование индикаторов. К титруемой пробе можно заранее добавить небольшое количество специального реактива - индикатора. Титрование надо будет прекратить в тот момент, когда индикатор под действием введенного титранта изменит видимую окраску, это и есть конечная точка титрования. Важно, чтобы изменение окраски происходило не постепенно, а в результате добавления всего одной «лишней» капли титранта. В некоторых случаях индикатор меняет не свою окраску, а растворимость или характер свечения. Однако такие индикаторы (адсорбционные, флуоресцентные, хемилюминесцентные и др.) применяют намного реже, чем цветные индикаторы. Изменение окраски любого индикатора происходит благодаря химическому взаимодействию индикатора с титрантом, приводящему к переходу индикатора в новую форму. Свойства индикаторов необходимо рассмотреть более детально.
Индикаторы
В аналитических лабораториях применяют несколько сот цветных индикаторов разного типа (кислотно-основные, металлохромные, адсорбционные и т.п.). Когда-то в качестве индикаторов использовались настойки, полученные из растений - из цветов фиалки или из особого вида лишайников (лакмус). Впервые такие индикаторы стал применять еще Р.Бойль. В настоящее время природные индикаторы не используют, поскольку они всегда являются смесью разных веществ, поэтому переход их окраски выражен недостаточно четко. Современные индикаторы – это специально синтезированные индивидуальные органические соединения. Как правило, индикаторами являются соединения ароматического ряда, молекулы которых содержат несколько функциональных групп (заместителей). Известно множество подобных соединений, но только некоторые из них можно применять в качестве цветных индикаторов. Предполагаемый индикатор должен отвечать целому ряду требований:
· индикатор должен хорошо растворяться, давая растворы, устойчивые при хранении;
· в растворе индикатор должен существовать в нескольких формах, различных по структуре молекулы. Между формами должно устанавливаться подвижное химическое равновесие. Например, кислотная форма индикатора переходит в основную (и обратно), окисленная - в восстановленную (и обратно); металлохромный индикатор обратимо связывается в комплекс с ионами металла, и т.п.;
· цветной индикатор должен интенсивно поглощать свет в видимой области спектра. Окраска его раствора должна быть различима даже при очень низкой концентрации (10-6 – 10-7 моль/л). В этом случае можно будет вводить в титруемый раствор очень малые количества индикатора, что способствует получению более точных результатов анализа;
· разные формы индикатора должны быть различны по своей окраске, то есть по спектру поглощения в видимой области. В таком случае в ходе титрования будет наблюдаться контрастный цветовой переход. Например, переход окраски индикатора из розовой в изумрудно-зеленую хорошо заметен на глаз. Зафиксировать же конечную точку титрования (к.т.т.) по переходу розовой окраски в оранжевую или фиолетовую гораздо труднее. Очень важно, насколько различны спектры поглощения двух форм индикатора. Если одна из форм индикатора максимально поглощает свет с длиной волны λ1, а другая - с длиной волны λ2, то разность ∆λ = λ1 - λ2 характеризует контрастность цветового переход. Чем больше ∆λ, тем лучше воспринимается на глаз переход окраски индикатора. Для повышения визуальной контрастности цветового перехода иногда используют смеси разных индикаторов или к индикатору добавляют посторонний инертный краситель;
· переход индикатора из одной формы в другую при изменении состава раствора должен проходить очень быстро, за доли секунды;
· переход должен вызываться единственным фактором, одним и тем же у всех индикаторов данного типа. Так, изменение окраски кислотно-основного индикатора не должно происходить за счет реакций другого типа, например при взаимодействии с окислителями, или ионами металлов, или белками! Напротив, редокс-индикаторы должны менять свою окраску только вследствие взаимодействия с окислителями и восстановителями, и происходить это должно при определенном потенциале, специфическом для каждого редокс-индикатора. Окраска этих индикаторов и потенциал перехода не должны зависеть от рН раствора. К сожалению, на практике потенциал перехода многих редокс-индикаторов зависит и от рН.
Чтобы ослабить влияние побочных процессов, иногда индикатор не вводят в титруемый раствор, а, наоборот, в ходе титрования периодически отбирают каплю титруемого раствора, смешивают ее на часовом стекле с каплей раствора индикатора и наблюдают, какая окраска получается. Такой прием позволяет использовать необратимо реагирующие индикаторы. С «внешним индикатором» удобнее работать, если заранее пропитать им бумагу.
Конечная точка титрования, фиксируемая по переходу окраски индикатора, может не совпадать с точкой эквивалентности. Несовпадение Vк.т.т. и Vт.экв приводит к систематической погрешности результата анализа. Величина погрешности определяется природой данного индикатора, его концентрацией и составом титруемого раствора.
Принцип подбора индикаторов очень
прост и универсален: характеристика перехода индикатора
(рТ-показатель титрования, потенциал перехода и т.п.) должна соответствовать
ожидаемому составу титруемого раствора в
точке эквивалентности. Так, если аналитик титрует водный раствор сильной
кислоты сильным основанием, в точке эквивалентности раствор будет иметь рН = 7.
Следовательно, надо использовать кислотно-основной индикатор, который меняет
свою окраску приблизительно при рН 7 (бромтимоловый синий и т.п.). Необходимые сведения о рТ - показателях
титрования для индикаторов разного типа есть в справочной литературе.
Расчет
результатов титриметрического анализа
Результаты
титриметрического анализа не рекомендуется рассчитывать непосредственно по
уравнению реакции, например, с помощью пропорций. Такой «школьный» способ
решения расчетных задач нерационален и, как правило, не дает требуемой точности. Результаты титриметрического
анализа рассчитывают по одной из нескольких
готовых алгебраических формул, выведенных на основании закона
эквивалентов. Исходными данными будут oбъем затраченного титранта (в
миллилитрах) и концентрация титранта (в моль/литр), их надо установить с необходимой
точностью.
Способ расчета не зависит от типа химической реакции, протекающей в ходе титрования, и способа контроля точки эквивалентности (индикатор, прибор и
т.п.). Выбор расчетной формулы определяется тем, какой
способ титрования (прямое,
обратное, заместительное) применяют в
ходе анализа. Выбирая формулу, следует различать два случая: а) расчет
концентрации раствора Х; б) определение массовой доли компонента (процентного
содержания Х в пробе).
Наиболее просто выглядят расчетные
формулы, если концентрации
определяемого компонента и титранта
выражают числом молей их эквивалентов в
литре соответствующих растворов, т.е. используют концентрации определяемого
компонента (Nx) и титранта (NT), выраженные числом молей эквивалента в литре раствора. Ранее эти
концентрации называли нормальными. Теперь этот термин применять не
рекомендуется, но на практике его используют весьма широко, особенно в
редоксметрии. А вот в комплексонометрии и в некоторых других методах, где 1
моль определяемого вещества Х всегда реагирует с 1 молем титранта, нормальные
концентрации совпадают с обычными молярными концентрациями (Cx и СТ), а поэтому при расчете результатов нормальные концентрации и эквиваленты
применять незачем.
В отличие от обычных молярных
концентраций, нормальная концентрация определяется с учетом химизма реакции,
протекающей в ходе титрования. Полезно запомнить, что нормальная концентрация Х в растворе либо
равна его молярной концентрации, либо превосходит ее в несколько
(2,3,4....) раз, смотря по тому, сколько протонов (или
электронов) участвует в реакции, в расчете на одну частицу Х. При записи
уравнения реакции, определении
эквивалентов и расчете нормальных концентраций следует учитывать условия, в которых протекает титрование,
и даже выбор индикатора.
Масса оттитрованного X при прямом титровании равна (в мг):
mx = NT
.VT
.Эx ,
(1),
где
Эx - молярная масса эквивалента
Х, соответствующая одному протону (в кислотно-основных реакциях), одному электрону (в
окислительно-восстановительных реакциях),
одному лиганду (в реакциях
комплексообразования), и т.п. VT – объем титранта (в мл). В
комплексонометрии массу определяемого
вещества (в мг) лучше рассчитывать по формуле, в которую входит величина Мх - молярная масса Х:
mx = СT .VT .Мx
(2).
Из (4.11) следует, что массовая доля Х в
навеске пробы, выраженная в %, равна:
%X
= NT
. VT . Эx . 100 % / mS ,
(3),
где
mS - масса навески в мг. Обычно результат титрования не зависит от
того, в каком объеме воды растворили
навеску пробы перед титрованием, и этот объем в расчетах не учитывают. Если же
титруют не всю навеску, а некоторую ее часть (аликвоту), то надо учесть
дополнительный коэффициент К, равный отношению V0 - объема
раствора, в который перевели эту навеску и из которого отбирали
аликвоты, к Valiq - объему одной
аликвоты:
mx = К . NT .VT .Эx , (4).
При расчете концентрации по способу прямого (или
заместительного) титрования применяют простую формулу, непосредственно следующую из
закона эквивалентов:
Nх . Vх = NT
. VT (5).
анализа,
однако в заводских лабораториях пользуются и другими способами расчета.
Приготовление
рабочих растворов в титриметрии
Применяемые в титриметрическом анализе рабочие растворы точно известной концентрации готовят несколькими способами:
· по точной навеске химического реактива, взятой на аналитических весах. Эту навеску растворяют в небольшом количестве растворителя, а затем в мерной колбе доводят объем полученного раствора до метки. Полученные растворы называют стандартными, а соответствующие реактивы – первичными стандартами. Лишь немногие вещества могут быть первичными стандартами – они должны быть чистыми химическими веществами постоянного и точно известного состава, твердыми при комнатной температуре, устойчивыми на воздухе, не гигроскопичными и не летучими. Примерами могут быть дихромат калия, комплексон III, щавелевая кислота. Напротив, по навеске нельзя приготовить стандартный раствор соляной кислоты (реактив «соляная кислота» - жидкость с неточно известным составом), хлорида двухвалентного железа (быстро окисляется на воздухе), едкого натра (гигроскопичен) и многих других веществ.
· из фиксаналов. Этим термином называют запаянную стеклянную ампулу, в которой содержится определенное количество реагента, обычно 0,1000 моль эквивалента. Фиксаналы готовят в заводских условиях. Если в лаборатории количественно перенести содержимое фиксанала в мерную колбу на 1000 мл и довести растворителем до метки, получится литр точно 0,1000 н раствора. Приготовление фиксанальных растворов не только экономит время аналитика, но и позволяет готовить растворы с точно известной концентрацией из таких веществ, которые не обладают комплексом свойств, необходимых для первичных стандартов (например, фиксанальные растворы соляной кислоты, аммиака или иода).
· по приблизительно известной навеске химического реактива, взятой на технических весах. Эту навеску растворяют в приблизительно известном количестве растворителя. Затем проводят дополнительную операцию – стандартизацию полученного раствора. Например, титруют полученным раствором точную навеску другого вещества (первичного стандарта). Можно поступить и по-другому: взять известный объем (аликвоту) приготовленного раствора и оттитровать его подходящим стандартным раствором. По объему, пошедшему на титрование, рассчитывают точную концентрацию приготовленного раствора. Такие растворы называют стандартизованными. Например, раствор КОН стандартизуют по навеске щавелевой кислоты или с помощью фиксанального раствора соляной кислоты. Если вещество в лаборатории имеется в виде концентрированного раствора приблизительно известной концентрации (например, соляная кислота), то вместо его взвешивания отмеривают некоторый, заранее рассчитанный объем концентрированного раствора. Это требует знания плотности исходного раствора. Затем, как и в предыдущем случае, стандартизуют полученный раствор.
Концентрация растворов не должна самопроизвольно
изменяться при хранении. В этом случае заранее приготовленные (стандартные или
стандартизованные) растворы можно будет использовать для проведения
титрований без каких-либо дополнительных
операций. Следует учесть, что чем более разбавлен
раствор, тем, как правило, он менее устойчив при хранении (гидролиз
растворенного вещества, его окисление кислородом воздуха, адсорбция на внутренней
поверхности стеклянной посуды и др.). Поэтому
рабочие растворы с низкой
концентрацией, как правило, не готовят заранее. Их готовят лишь по мере
надобности, в день употребления. Для этого разбавляют исходные (стандартные,
фиксанальные или стандартизованные) растворы чистым растворителем в точно
известное число раз (обычно за одну операцию раствор разбавляют в 5 или 10
раз). Если требуются еще более разбавленные растворы, то эту операцию повторяют.
Например, из
Приготовление растворов с точно известной концентрацией требует использования целого набора специальной мерной посуды, позволяющей измерять объемы с требуемой точностью. Это мерные колбы, пипетки и бюретки. В руководствах к лабораторным работам приводятся описания мерной посуды и правила работы с ней.
Методы титрования
Метод отдельных навесок и метод аликвот. Для уменьшения влияния случайных погрешностей титрование обычно повторяют несколько раз, а затем усредняют результаты. Повторные анализы можно проводить двумя разными способами: по методу отдельных навесок и по методу аликвот. Оба способа используют и при стандартизации рабочих растворов, и непосредственно в анализе реальных объектов.
Метод отдельных навесок, как ясно из его названия, предполагает, что для титрования берут несколько навесок анализируемого материала. Массы их должны быть приблизительно равны. Размер навески выбирают с учетом желаемого расхода титранта на одно титрования (не более объема бюретки) и с учетом концентрации титранта.
Пусть взяты три навески щавелевой кислоты, массы которых указаны в табл.2. По данным каждого титрования вычисляют (по отдельности!) концентрацию КОН. Затем усредняют концентрации. Объемы, затраченные на титрование разных навесок, усреднять нельзя!
Таблица 2. Пример
расчета результатов анализа по методу отдельных навесок
|
Номер навески |
Масса навески, мг |
Объем титранта, мл |
Найденная концентрация КОН, моль/л |
|
1 |
95,7 |
14,9 |
0,102 |
|
2 |
106,9 |
16,2 |
0,105 |
|
3 |
80,8 |
12,7 |
0,101 |
|
Средний результат анализа СКОН
= 0,103 моль/л |
|||
Метод титровпания аликвот (или метод пипетирования) основан на титровании нсекольких отдельных аликвот – небольших объемов исследуемого раствора, отобранных с помощью пипеток.
Метод
отдельных навесок и метод
титрования аликвот используют не только при прямом титровании,
как это показано в приведенных примерах, но и при обратном, и при заместительном
титровании. Выбирая способ титрования, следует учесть, что метод отдельных
навесок дает более точные результаты, но он более трудоемкий и требует большего объема расчетов. Поэтому метод
отдельных навесок лучше использовать для
стандартизации рабочих растворов, а для серийно выполняемых анализов применять более экспрессный метод
аликвот.
Форма кривых титрования
Логарифмические кривые титрования представляют графическую зависимость логарифма равновесной концентрации одного из реагентов от объема добавленного титранта. Вместо логарифма концентрации на вертикальной оси обычно откладывают величину рН раствора (водородный показатель). Применяют и другие аналогичные показатели (например, pAg = - lg[Ag+]), а также величину тех физико-химических свойств титруемого раствора, которые линейно зависят от логарифмов равновесных концентраций. Примером может быть электродный потенциал (E).
Если в растворе содержится только одно вещество, реагирующее с титрантом, причем реакция описывается единственным химическим уравнением (то есть проходит не ступенчато)- на логарифмической кривой наблюдается почти вертикальный участок, называемой скачком титрования. Напротив, участки кривой вдали от т.экв. близки к горизонтальным. Примером могут быть зависимости рН растворов от объема V добавленного титранта, показанные на рис.1
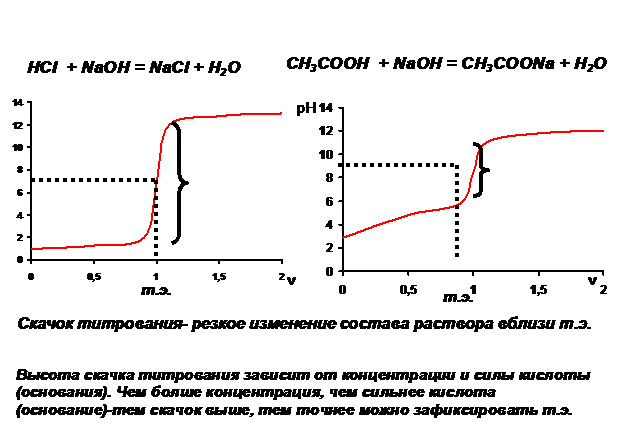
Рис.1. Вид кривых титрования
Чем выше высота скачка на кривой тирования, тем точнее можно зафиксировать точку эквивалентности.
Кислотно-основное титрование
(метод нейтрализации)
Принцип метода
Метод нейтрализации основан на проведении кислотно-основных (протолитических) реакций. В ходе такого титрования меняется значение рН раствора. Кислотно-основные реакции подходят для титриметрического анализа в наибольшей степени: они протекают по строго определенным уравнениям, без побочных процессов и с очень высокой скоростью. Взаимодействие сильных кислот с сильными основаниями приводит к высоким константам равновесия. Для обнаружения к.т.т. существует удобный и хорошо изученный способ - применение кислотно-основных индикаторов. Можно использовать и инструментальные методы, они особенно важны при титровании неводных, мутных или окрашенных растворов.
Метод нейтрализации включает два варианта – ацидиметрию (титрант – раствор сильной кислоты) и алкалиметрию (титрант – раствор сильного
основания). Эти методы соответственно применяют для определения оснований и
кислот, в том числе ионных и многопротонных. Возможность титрования сильных
протолитов определяется их концентрацией; титрование возможно, если Сх > 10-
H3O+ + OH- ® 2 Н2О
Титрование слабых кислот и слабых оснований в водных растворах соответствует схемам:
НА + ОН- ® Н2О (алкалиметрия)
В + Н3O+ ® НВ+ + Н2О (ацидиметрия)
Примеры практического применения
кислотно-основного титрования:
· определение кислотности пищевых продуктов, почв и природных вод (алкалиметрическое титрование водных растворов с индикатором фенолфталеином);
· определение кислотности нефтепродуктов (алкалиметрическое титрование неводных растворов с инструментальным контролем к.т.т.);
· определение карбонатов и гидрокарбонатов в минералах и строительных материалах (ацидиметрическое титрование водных растворов с двумя индикаторами);
· определение азота в солях аммония и в органических веществах (метод Кьельдаля). В этом случае органические азотсодержащие вещества разлагают кипячением с концентрированной серной кислотой в присутствии солей ртути, аммонийный азот отгоняют действием щелочи при нагревании, аммиак поглощают стандартным раствором НСl, взятым в избытке. Затем титруют щелочью непрореагировавшую часть НСl в присутствии индикатора метилового оранжевого. В данной методике используют и принцип замещения, и способ обратного титрования.
Рабочие растворы. При ацидиметрическом титровании водных растворов в качестве титрантов
используют растворы сильных кислот (НСl, реже НNO3 или H2SO4). В алкалиметрии титранты -
растворы NaOH или КОН.
Однако перечисленные реагенты не обладают свойствами, которые позволяли бы готовить из них стандартные растворы просто по точной навеске. Так, твердые щелочи
гигроскопичны и всегда содержат примеси карбонатов. В случае НСl и
других сильных кислот исходный реактив представляет собой не чистое вещество, а
раствор с неточно известной концентрацией. Поэтому в методе нейтрализации
вначале готовят раствор с приблизительно известной концентрацией, а потом стандартизуют его. Растворы кислот стандартизуют
по безводному карбонату натрия Na2CO3 (соде) или по
тетраборату натрия Na2B4O7 .10Н2О
(буре). Бура при растворении взаимодействует с водой:
В4О72–+3Н2О=2Н3ВО3 + 2ВО2–
Образовавшийся метаборат - довольно сильное основание. Его титруют кислотой:
ВО2– + Н3О+ = Н3ВО3.
Очевидно, что молярная масса эквивалента буры равна М (½Na2B4O7.10Н2О) = 190.71 г/моль. Высокая молярная масса эквивалента – преимущество буры как первичного стандарта. Растворы щелочей стандартизуют по гидрофталату калия. Молекула гидрофталата содержит подвижный протон и обладает свойствами слабой кислоты:
![]()
В качестве стандартов нередко используют бензойную кислоту С6Н5СООН,
щавелевую кислоту H2C2O4.2H2O и другие слабые
органические кислоты (твердые, чистые устойчивые вещества). Стандартные
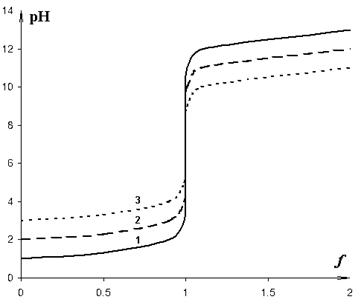
Рис. 2. Кривые нейтрализации сильной кислоты.
1 -
Для обнаружения к.т.т. с цветным индикатором необходимо, чтобы высота скачка была больше, чем ширина интервала перехода индикатора. Последняя обычно составляет около двух единиц рН.
Высота скачка на кривой нейтрализации слабых кислот зависит от силы кислоты (величины ее кислотной константы, или рKa ). А именно, чем слабее кислота (чем больше величина рКа), тем меньше при прочих равных условиях должны быть высота скачка.
Метиловый оранжевый![]()
![]()
![]()
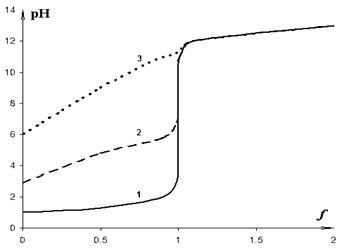
Рис. 3. Кривые
нейтрализации
1 - соляная кислота, 2 – уксусная кислота (рКа = 4,8), 3 – синильная кислота (pKa = 9,2).
Высота скачка должна быть больше ширины зоны перехода индикатора, которая, как правило, составляет 2 единицы рН. Поэтому, как и в случае сильных электролитов, критерий возможности титрования слабого протолита с 1 %-ной ошибкой можно вывести из условия ∆pН±1% ≥ 2. Для водного раствора слабой кислоты получаем искомый критерий в следующей форме:
рКa + рС ≤ 8
При pС = 2 критическое значение рКа равно 6. Иными словами, если кислота очень слабая, и ее рКа больше 6, то точно оттитровать ее с цветными индикаторами нельзя.
Титрование смесей протолитов и многопротонных протолитов. В смешанных растворах сильные кислоты подавляют протолиз более слабых. То же наблюдается в растворах, содержащих смесь оснований разной силы. При добавлении к такой смеси титранта прежде всего оттитровывается более сильный протолит, а уже затем с титрантом реагирует более слабый. Однако число скачков, наблюдаемых на кривой титрования смеси, зависит не только от числа присутствующих протолитов, но и от абсолютных значений соответствующих констант кислотности (основности), а также от их соотношения. Константы кислотности (или основности) компонентов смеси должны различаться более чем в 104, раз, только в этом случае на кривой титрования будут раздельно наблюдаться отчетливо выраженные скачки титрования, а относительная ошибка определения каждого компонента не превысит 1 %. Критерием возможности раздельного титрования протолитов является так называемое «правило четырех единиц»:
![]() (6)
(6)
Многопротонные протолиты реагируют с титрантами ступенчато, сначала по первой ступени, затем по второй и т.д., если соответствующие константы кислотности различаются в соответствии с условием (6). При расчете кривых нейтрализации многопротонные протолиты можно рассматривать как смеси разных электролитов.
В качестве примера проанализируем возможность ступенчатого титрования такого практически
важного вещества, как ортофосфорная кислота.
![]()
![]()
![]()
![]()
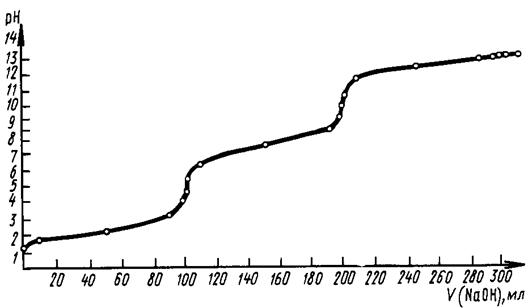
Рис.4. Кривая
титрования орто-фосфорной кислоты щелочью
Аналогично можно
рассматривать нейтрализацию многопротонных оснований. Так, при титровании
карбонат-ионов сильными кислотами на кривой титрования следует ожидать двух
раздельных скачков титрования, соответствующих превращению карбонат-ионов
вначале в гидрокарбонат, а затем и в угольную кислоту.
![]()
![]()
![]()
![]()
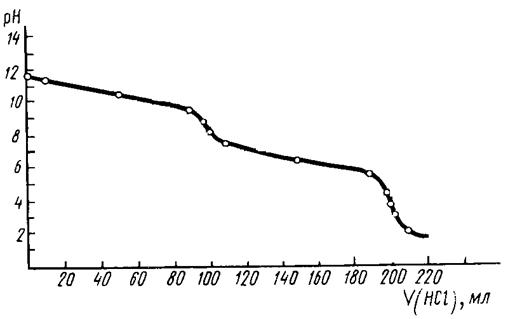
Рис.5. Кривая
титрования смеси карбонат- и гидрокарбонат-ионов раствором HCl.
Указаны значения рН, при которых наблюдаются переходы окраски индикаторов.
При титровании смеси двух сильных кислот, смеси двух
одинаково слабых кислот или смеси двух оснований с близкими рКb двух раздельных скачков на кривой титрования
нет. Однако определить концентрацию компонентов таких смесей по отдельности все
же вполне возможно. Эти задачи успешно решают, используя дифференцирующие
неводные растворители.
Кислотно-основные индикаторы и их выбор
Для обнаружения к.т.т. в методе нейтрализации традиционно используют кислотно-основные индикаторы – синтетические органические красители, являющиеся слабыми кислотами или основаниями и меняющие видимую окраску в зависимости от рН раствора. Примеры некоторых (наиболее часто применяемых в лабораториях) кислотно-основных индикаторов приведены в таблице 3. Строение и свойства индикаторов приведены в справочниках. Важнейшими характеристиками каждого кислотно-основного индикатора являются интервал перехода и показатель титрования (pT). Интервал перехода – это зона между двумя значениями рН, соответствующими границам зоны, внутри которой наблюдается смешанная окраска индикатора. Так водный раствор метилового оранжевого наблюдатель охарактеризует как чисто желтый – при рН < 3,1 и как чисто красный при рН > 4,4, а между этими граничными значениями наблюдается смешанная, розово-оранжевая окраска разных оттенков. Ширина интервала перехода обычно составляет 2 единицы рН. Экспериментально определенные интервалы перехода индикаторов в некоторых случаях меньше или больше двух единиц рН. Это, в частности, объясняется различной чувствительностью глаза к разным участкам видимой области спектра. Для одноцветных индикаторов ширина интервала зависит и от концентрации индикатора.
Таблица 3
Важнейшие
кислотно-основные индикаторы
|
Индикатор |
Интервал перехода ΔрНInd |
рТ |
рКa(HInd) |
Изменение окраски |
|
Метиловый оранжевый |
3.1 - 4.4 |
4.0 |
3.5 |
Красная - желтая |
|
Бромкрезоловый зеленый |
3.8 - 5.4 |
4.5 |
4.9 |
Желтая - синяя |
|
Метиловый красный |
4.2 - 6.2 |
5.5 |
5.0 |
Красная - желтая |
|
Бромкрезоловый пурпурный |
5.2 - 6.8 |
6.0 |
6.4 |
Желтая - фиолетовая |
|
Бромтимоловый синий |
6.0 - 7.6 |
7.0 |
7.3 |
Желтая - синяя |
|
Феноловый красный |
6.8 - 8.4 |
7.5 |
8.0 |
Желтая - красная |
|
Тимоловый синий |
8.0 - 9.6 |
8.5 |
9.2 |
То же |
|
Фенолфталеин |
8.2 - 10.0 |
9.0 |
9.5 |
Бесцветная - красная |
Зная характеристики разных индикаторов, можно теоретически обоснованно подбирать их, чтобы получить правильные результаты анализа. Придерживаются следующего правила: интервал перехода индикатора должен лежать в области скачка на кривой титрования.
При выборе индикаторов для
титрования слабых протолитов необходимо учитывать, что т.экв. и скачок
титрования смещены в слабощелочную среду при титровании кислоты и в слабокислую
среду – при титровании основания. Следовательно, для титрования слабых кислот подходят индикаторы, меняющие свою окраску
в слабощелочной среде (например, фенолфталеин), а для титрования слабого
основания – индикаторы, меняющие окраску
в слабокислой среде (например, метиловый оранжевый
Существует ещё одна характеристика каждого кислотно-основного индикатора – это показатель титрования (рТ). Так называют значение рН, при котором наблюдатель наиболее отчетливо замечает изменение окраски индикатора и именно в этот момент считает титрование законченным. Очевидно, рТ = рНК.Т.Т.. Выбирая подходящий индикатор, надо стремиться к тому, чтобы величина рТ была бы как можно ближе к теоретически рассчитанной величине рНТ.ЭКВ.. Обычно значение рТ близко к середине интервала перехода. Но рT – плохо воспроизводимая величина. Разные люди, проводящие одно и то же титрование с одним и тем же индикатором, получат существенно различные значения pT. К тому же величина рТ зависит от порядка титрования, то есть от направления изменения окраски. При титровании кислот и оснований с одним и тем же индикатором значения рТ будут несколько различаться. Для одноцветных индикаторов (фенолфталеин и т.п.) величина рТ зависит и от концентрации индикатора.