Реакции комплексообразования
и их применение в анализе
Общие сведения. Вначале реакции комплексообразования нашли свое применение в качественном анализе – образование или разрушение окрашенных комплексов позволяет обнаружить многие вещества, в частности, катионы переходных металлов. Позднее некоторые из этих реакций стали использовать и для количественного анализа:
-малорастворимые комплексные соединения могут быть осаждаемой и даже гравиметрической формой.
-реакции образования комплексных соединений – основа метода комплексометрии, широко распространенного в практике титриметрического анализа
- в фотометрическом анализе определяемые вещества переводят в поглощающие свет (окрашенные) комплексы, а уже затем измеряют аналитический сигнал
- аналогичные реакции позволяют проводить экстракционное разделение и концентрирование микропримесей.
-наконец, с помощью реакций комплексообразования можно целенаправленно регулировать кислотно-основные или окислительно-восстановительные свойства определяемых веществ.
Строение и состав комплексных соединений впервые были объяснены А. Вернером на рубеже XIX и XX веков. Любой комплекс должен включать центральный атом, или ион (комплексообразователь) и лиганды (молекулы или анионы). Они связаны ковалентными связями. Получающуюся при таком взаимодействии устойчивую заряженную частицу можно рассматривать как внутреннюю сферу комплексного соединения, с которой слабо связаны ионы внешней сферы. Последние имеют заряд, противоположный заряду внутренней сферы, и удерживаются около нее ионными связями. Из раствора кристаллизуются именно такие – нейтральные – комплексные соединения. Примеры – К4[Fe(CN)6] или [Cu(NH3)4]Cl2.
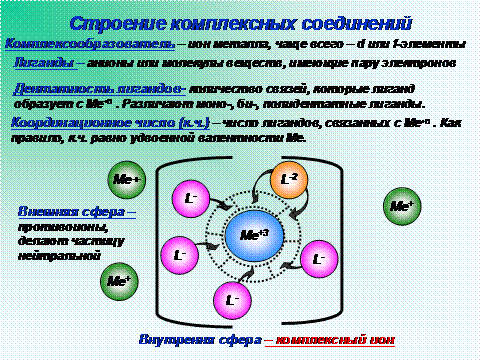
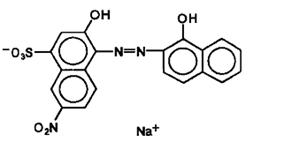
К3[Fe(CN)6] – гксацианоферрат калия. Fe+3 – комплексообразователь, CN- - лиганды, 6-координационное число, 3 иона К+ образуют внешнюю сферу, а комплексный ион [Fe(CN)6]-3 представляет собой внутреннюю сферу.
Свойства выделенных из раствора нейтральных комплексных соединений изучают специалисты в области неорганической и координационной химии.
Несколько по-другому подходят к комплексообразованию аналитики. Они изучают и применяют реакции между комплексообразователем и лигандами, идущие в растворе. В водном растворе «внутренняя сфера» является самостоятельной частицей, ионы внешней сферы связаны с ней очень слабо, практически не влияя на важные для анализа характеристики. Поэтому аналитики считают комплексными соединениями продукты взаимодействия центрального атома с лигандами, независимо от наличия заряда у образующегося соединения и возможности его препаративного выделения. Соответственно комплексом (комплексной частицей) они называют ион или молекулу, в состав которых входят более простые частицы, способные к самостоятельному существованию в растворе (или в составе кристалла). Примерами могут быть анионный гексароданидный комплекс Fe(SCN)63-, нейтральный комплекс FeСl3 или катионный комплекс Cu(NH3)42+. А вот сульфат-анион комплексом не является, так как атомы кислорода и серы в соответствующих степенях окисления не способны к самостоятельному существованию в растворе.
Способность комплексообразователя образовывать определенное число химических связей с лигандами характеризуют его координационным числом. Чаще всего оно равно 4 или 6. В анализе применяют устойчивые комплексные соединения переходных металлов, свинца, олова, алюминия, редкоземельных элементов и т.п. Однако широко используются и такие комплексы, в которых центральным атомом является неметалл (например, As или P).
Число связей, которые лиганд образует с комплексообразователем, называют его дентатностью. Неорганические лиганды обычно монодентатны: аммиак, вода, фторид-, хлорид-, цианид-ион и др. Бидентатными лигандами являются некоторые двухзарядные анионы (например, сульфат SO42-), бифункциональные органические соединения (диамины, многие аминокислоты и оксикислоты, оксалат С2О42 и другие анионы двухосновных карбоновых кислот). Существуют и лиганды с более высокой дентатностью, соответствующие органические молекулы содержат 3-6 функциональных групп донорного характера, каждая из которых образует одну связь с центральным атомом. Эти функциональные группы (-ОН, -СООН, -NH2 и некоторые другие) имеют неподеленные электронные пары, обеспечивающие образование связи с комплексообразователем.
· Наибольшую практическую значимость имеют такие комплексы, которые содержат один центральный атом, а вся его координационная сфера заполнена одинаковыми лигандами.
Соотношение между координационным числом комплексообразователя и дентатностью лиганда определяет возможный состав комплекса. Так, катион Al3+ с координационным числом 6 может присоединить 6 монодентатных лигандов (пример – фторидный комплекс AlF63-), или 3 бидентатных лиганда (оксалатный комплекс Al(С2О4)3-), или 2 тридентатных лиганда. Учитываются и пространственные (стерические) факторы. Так, если молекула монодентатного лиганда очень велика по объему, и несколько таких молекул у одного и того же комплексообразователя не помещаются, то в координационной сфере центрального атома свободные места занимают молекулы растворителя или какого-либо другого лиганда.
Комплексы с полидентатными лигандами называют хелатами. Разные функциональные группы одного и того же лиганда при этом захватывают центральный атом с разных сторон, как клешня краба (слово хелат в переводе с греческого и обозначает клешню). Нередко молекула реагента превращается в лиганд, теряя атомы водорода, в этом случае раствор подкисляется. Примером может быть взаимодействие щавелевой кислоты с ионами цинка, в ходе которого образуется оксалатный комплекс:
2 H2C2O4 + Zn2+ ![]() Zn(С2O4)2 2- + 4 H+
Zn(С2O4)2 2- + 4 H+
O =C_________O O C = O Z n
O = C O O ________С =O
![]()
![]()
![]()
![]()
![]()
![]() 2-
2-
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Структура оксалатного комплекса
цинка (II)
Обычно используемые структурные формулы комплексных соединений имеют условный характер, на самом деле эти соединения имеют трехмерную, пространственную структуру, которую трудно передать схемой на плоскости.
В структуре хелатов можно выделить циклические группы из нескольких атомов. В цикл входит и центральный атом. Образование циклов увеличивает устойчивость комплексов (так называемый хелатоэффект). Особой прочностью отличаются комплексы с 5- или 6-членными циклами. В приведенной структуре комплекса цинка можно выделить два пятичленных цикла.
Наиболее широко в анализе используют реакции образования хелатных комплексов с участием комплексонов – полидентатных лигандов, обычно представляющих собой анионы полиаминополикарбоновых кислот.
Константы равновесий комплексообразования. В общем случае координационное число центрального атома и дентатность лиганда могут не совпадать, тогда реакция образования комплексов происходит ступенчато. Обозначая катион металла символом М, а лиганд символом R (заряды опускаем), можно записать равновесия комплексообразования следующим образом:
M + R ![]() M R
M R + R
M R
M R + R ![]() M R2 … M R n-1 + R
M R2 … M R n-1 + R ![]() M Rn
M Rn
Каждая ступень характеризуется своей константой устойчивости.
Помимо отдельных ступеней комплексообразования, образование комплекса из металла и нескольких лигандов можно характеризовать суммарной, или общей константой устойчивости b. Например, для комплекса MR2 рассматривают процесс
M + 2 R ![]() MR2,
MR2,
константа равновесия которого равна:
b2 = ![]() (1)
(1)
В общем случае для i-го комплекса
b i = ![]() (2)
(2)
Чем комплекс прочнее, тем больше численное значение b i
Очень важно предвидеть влияние рН на процесс комплексообразования. Многие
лиганды участвуют в конкурирующих протолитических реакциях. Если лиганд
представляет собой анион слабой кислоты, то он проявляет свойства слабого
основания. Тогда в кислой среде будет идти конкурирующая реакция перехода R в HR. Величина ![]() и степень образования
комплекса будут снижаться тем сильнее, чем ниже величина рН. С другой стороны,
для катионов М характерно образование
гидроксокомплексов и малорастворимых гидроксидов. В наибольшей степени такие реакции
происходят в щелочных средах. Величина
и степень образования
комплекса будут снижаться тем сильнее, чем ниже величина рН. С другой стороны,
для катионов М характерно образование
гидроксокомплексов и малорастворимых гидроксидов. В наибольшей степени такие реакции
происходят в щелочных средах. Величина ![]() и степень образования
комплекса в этом случае также снижаются,
тем сильнее, чем выше рН. Очевидно, зависимость
и степень образования
комплекса в этом случае также снижаются,
тем сильнее, чем выше рН. Очевидно, зависимость ![]() от рН имеет вид кривой
с максимумом, но где он находится – в слабокислой, нейтральной или слабощелочной
среде – определяется природой M
и R. Зная константы
равновесия всех побочных реакций, можно точно рассчитать, при каком рН процесс
образования некоторого комплекса пойдет в максимальной степени.
от рН имеет вид кривой
с максимумом, но где он находится – в слабокислой, нейтральной или слабощелочной
среде – определяется природой M
и R. Зная константы
равновесия всех побочных реакций, можно точно рассчитать, при каком рН процесс
образования некоторого комплекса пойдет в максимальной степени.
Маскирование. При определении некоторого М химическими методами влияние мешающего компонента М* стараются устранить без удаления М* из исследуемого раствора, то есть путем маскирования. Маскирующее вещество R должно реагировать с М*, но не с М. Чаще всего для маскирования применяют реакции комплексообразования. Мешающие компоненты пробы переводят в достаточно прочные и хорошо растворимые бесцветные комплексы. В результате равновесная концентрация М* снижается.
В качестве маскирующих реагентов-лигандов для катионов металлов часто используют аммиак, тиосульфат, фториды, полифосфаты, а также комплексоны, оксикислоты (винная, лимонная и др.), соли этих кислот, полиамины и другие органические вещества. Именно эффект образования прочных бесцветных комплексов лежит в основе действия «оптических» отбеливателей белья, средств для удаления пятен, в частности, ржавчины и пр.




Комплексонометрическое титрование (комплексонометрия).
В аналитических лабораториях комплексонометрия
стала основным методом определения макроколичеств (>0,1%) многих
металлов, важным способом анализа горных пород, сплавов, стройматериалов,
технологических растворов, почв, биологических объектов и др. В настоящее время
так определяют более 30 металлов. Катионы, дающие лабильные комплексы,
определяют путем прямого титрования. Катионы,
медленно реагирующие с комплексонами (Al3+, Cr3+), обычно определяют с
помощью обратного титрования. А именно, добавляют к пробе избыток комплексона,
а затем непрореагировавшую часть
комплексона оттитровывают стандартным раствором соли магния (цинка, меди). Обратным или заместительным титрованием
определяют и некоторые анионы, образующие осадки с катионами металлов. В
частности, фосфаты осаждают в виде NH4MgPO4, а затем оттитровывают избыток ионов магния комплексоном. Так же определяют
сульфаты (их осаждают в виде BaSO4) и многие органические вещества.
В комплексонометрии
титрантом обычно служит этилендиаминтетраацетат натрия (ЭДТА), или, как его еще называют, комплексон
III. Структурная формула ЭДТА:
HOOC—CH2 CH2—COOH
\ /
N—CH2—CH2—N
/ \
NaOOC—CH2 CH2—
COONa
ЭДТА – кислая
соль слабой четырехосновной этилендиаминтетрауксусной кислоты. Этот реагент используют и в других методах анализа, в частности,
как маскирующий реагент. ЭДТА применяют в технике (устранение жесткости воды,
очистка поверхностей от накипи) и даже в медицине (растворение камней в почках
и т.п.).
В уравнениях химических реакций формулу ЭДТА обычно записывают в виде Na2H2Y. Раствор ЭДТА готовят по
точной навеске кристаллогидрата Na2H2Y. 2 Н2О
или из фиксанала. При необходимости
раствор стандартизуют по навеске MgSO4.7H2O или
по навеске металлического цинка, растворенной в HCl. При хранении титрант устойчив. Особенность ЭДТА – одинаковая
стехиометрия (1:1) реакций с любыми
катионами металлов. Поэтому при расчете результата анализа не следует
использовать молярную концентрацию эквивалента ЭДТА, рассчитывают обычные
молярные концентрации.
В растворе
ЭДТА в результате протолиза образуется смесь форм разной протонированности[1]: H2Y2–,
H3Y–, H4Y, HY3–, Y4–.
Между ними устанавливается равновесие. Доминирование той или иной формы определяется
значением рН раствора. Лигандом, непосредственно входящим в состав комплексов с
металлами, обычно является анион Y4–, хотя в реакции принимают участие и другие формы
ЭДТА. Комплексы ЭДТА с металлами, как и сам
реагент, хорошо растворимы в воде. Устойчивость комплексов разных металлов
различна (табл. 1)- чем прочнее компрлекс, тем больше величина логарифма
константу устойчивости комплекса, lgb.
Таблица 1
Устойчивость комплексов
некоторых металлов с ЭДТА
|
M |
lgb |
M |
lgb |
M |
lgb |
M |
lgb |
M |
lgb |
M |
lgb |
|
Na |
1,8 |
Ba (II) |
7,8 |
U (IV) |
10,4 |
Co (II), Zn |
16,3 |
Ni (II) |
18,6 |
Fe (III) |
24,2 |
|
Li |
2,8 |
Be (II) |
8,4 |
Ca (II) |
10,6 |
Al (III), Cd |
16,5 |
Cu (II) |
18,8 |
Bi (III) |
27,4 |
|
Tl (I) |
6,5 |
Sr (II) |
8,8 |
Mn(II) |
14,0 |
Pb (II) |
18,0 |
Hg(II) |
21,8 |
Zr (IV) |
29,5 |
|
Ag |
7,3 |
Mg(II) |
9,1 |
La(III) |
15,5 |
Sn (II) |
18,3 |
Cr III) |
23,4 |
Co (III) |
40,6 |
Образуя комплексы, молекула ЭДТА образует
две связи с помощью неподеленных электронных пар атома азота, а еще 4 – за счет
карбоксильных групп. Таким образом, ЭДТА является гексадентатным лигандом. В
структуре комплекса образуется несколько циклов, включающих атом металла. Все
формы ЭДТА реагируют с катионами металлов одинаковым образом, давая комплексы
состава 1:1, при этом вытесняются ионы натрия и водорода.
Если в растворе при выбранном значении рН доминирует какая-то одна форма ЭДТА, можно записать уравнение основной реакции, протекающей в ходе титрования, в традиционном виде. Например,
Fe3+ + H3Y- ![]() [FeY] – + 3 H+ рН 3;
[FeY] – + 3 H+ рН 3;
Zn2+
+ H2Y2– ![]() [ZnY]2– +
2 H+ рН 6;
[ZnY]2– +
2 H+ рН 6;
Ca2+ + HY3– ![]() [CaY]2–
+ H+ рН 9.
[CaY]2–
+ H+ рН 9.
В соответствии с принципом Ле-Шателье подкисление раствора сдвигает такие реакции влево, т.е.комплексы становятся мене устойчивыми.
Те металлы, которые дают более прочные комплексы, обычно титруют в более кислых средах. Так, катионы Fe3+, Bi3+, Zr4+, для которых lgb = 20-30, титруют при рН 1-3. Менее прочные комплексы других элементов в сильнокислых растворах не образуются, поэтому присутствие таких элементов (например, Ca2+) не повлияет на результат определения железа или висмута. Титрование ионов Cu2+, Co2+, Cd2+ для которых lgb = 15-20, проводят при рН 4 -10. Катионы щелочноземельных металлов, магния и серебра дают малопрочные комплексы (lgb = 8-10), титровать их можно только в щелочной среде. Наконец, катионы щелочных металлов (lgb = 1-3) реагируют с ЭДТА лишь в незначительной степени. Оттитровать их не удается (независимо от рН), титрованию других катионов они не мешают.
Металлохромные индикаторы. Некоторые катионы металлов титруют раствором ЭДТА в
присутствии специфических индикаторов, дающих с данным катионом окрашенные
соединения; например, индикаторы на катионы Fe3+ – тиоцианат-ион или сульфосалициловая кислота.
Для контроля к.т.т. используют также инструментальные методы (потенциометрию,
кондуктометрию и др.). Однако большинство методик комплексонометрического и
некоторые методики осадительного титрования основаны на применении металлохромных индикаторов (табл.2). Это органические соединения, содержащие
хромофорные структуры (например, бензольные кольца) и комплексообразующие
группы (гидроксильные или аминные). Например:
|
Эриохром черный Т
|
Мурексид ОNН4 / NН—С СО—NН / \\ / \ О=С С—N=С СО \ / \ / NН—СО СО—NН |
Такие индикаторы образуют комплексы с металлами, хотя и менее прочные, чем ЭДТА. Важнейшие металлохромные индикаторы принадлежат к группе азокрасителей (эриохром черный Т, 1-(2-пиридилазо)-2-нафтол и др.), либо к группе трифенилметановых красителей (ксиленоловый оранжевый, пирокатехиновый фиолетовый и др.). Используют индикаторы и других типов: мурексид, дитизон, ализарин и др. Но в любом случае комплекс металла с индикатором имеет окраску, отличную от окраски свободного индикатора. Титруемый раствор меняет окраску из-за смещения равновесия:
М
+ Ind ![]() МInd
МInd
Заряды ионов здесь для простоты опущены.
Индикатор может использоваться только при определенных значениях рН, при которых не образуются другие (в разной степени протонированные) формы индикатора, существует лишь свободный индикатор и его комплекс с металлом. Процессы, происходящие при титровании катиона металла в присутствии металлохромного индикатора, можно описать так.
1)
До начала титрования в анализируемый раствор вводят буферную систему и немного
индикатора. В результате реакции M + Ind ![]() MInd индикатор полностью связывается в комплекс,
раствор приобретает окраску комплекса M-Ind. Например, при определении
жесткости воды с эриохромом черным Т при рН 10 до начала титрования раствор имеет красную
окраску.
MInd индикатор полностью связывается в комплекс,
раствор приобретает окраску комплекса M-Ind. Например, при определении
жесткости воды с эриохромом черным Т при рН 10 до начала титрования раствор имеет красную
окраску.
2) В процессе титрования к
исследуемому раствору постепенно
добавляют ЭДТА, идет реакция М + Y ![]() MY. С
комплексом M-Ind изменений не
происходит, окраска сохраняется.
MY. С
комплексом M-Ind изменений не
происходит, окраска сохраняется.
3) В конце титрования,
когда в растворе почти не остается свободных ионов металла, происходит
реакция MInd + Y ![]() MY + Ind,
комплекс металл-индикатор (менее прочный, чем комплекс с ЭДТА)
разрушается, титруемый раствор от одной лишней капли приобретает окраску
свободного индикатора (в случае эриохром черного Т – голубую). Это и есть к.т.т. Очевидно,
заканчивать титрование надо не при смешанной окраске, отвечающей присутствию в
растворе Ind и MInd (еще не все
катионы металла прореагировали с ЭДТА), а при достижении чистой окраски свободного
индикатора. Последние капли титранта вводят медленно.
MY + Ind,
комплекс металл-индикатор (менее прочный, чем комплекс с ЭДТА)
разрушается, титруемый раствор от одной лишней капли приобретает окраску
свободного индикатора (в случае эриохром черного Т – голубую). Это и есть к.т.т. Очевидно,
заканчивать титрование надо не при смешанной окраске, отвечающей присутствию в
растворе Ind и MInd (еще не все
катионы металла прореагировали с ЭДТА), а при достижении чистой окраски свободного
индикатора. Последние капли титранта вводят медленно.
Таблица 2
Свойства некоторых металлохромных индикаторов
|
Индикатор |
Катион |
lgbМInd |
рН |
Изменение
окраски при прямом титровании
раствором ЭДТА |
|
Эриохром черный Т |
Mg2+ Mn2+ Zn2+ |
7,0 9,6 12,9 |
10 8–10 7–10 |
красная–синяя красная–синяя красная–синяя |
|
Ксиленоловый оранжевый |
Zn2+ Bi3+ |
6,1 5,5 |
5–6 1–3 |
розовая–желтая розовая–желтая |
|
Мурексид |
Ca2+ Cu2+ Ni2+ |
5,0 17,9 11,3 |
12–13 4 8,5–11,5 |
красная–фиолетовая оранжевая–красная желтая–пурпурная |
При выборе металлохромного индикатора учитывают следующие требования:
1) комплекс катиона металла с индикатором должен быть достаточно устойчивым, но менее прочным, чем комплекс этого металла с ЭДТА. Условные константы устойчивости этих комплексов должны различаться на 1-4 порядка;
2) комплекс
катиона металла с индикатором должен быстро
(в течение нескольких секунд) образовываться и быстро разрушаться под
действием ЭДТА.
3) интервал перехода индикатора должен входить в пределы скачка на кривой комплексонометрического титрования данного катиона.
4) окраски свободного
индикатора и комплекса должны быть контрастными.
Селективность комплексонометрического титрования. В целом ЭДТА – неселективный реагент. Во многих случаях комплексонометрическим методом определяют лишь суммарное содержание нескольких металлов. Например, жесткость воды – суммарную концентрацию катионов кальция и магния, а также некоторых других примесей. Жесткость воды определяют, титруя пробу раствором ЭДТА в присутствии аммиачного буферного раствора (рН 10). Обычно используют индикатор эриохром черный Т.
Если не удается подобрать подходящий прием улучшения селективности, мешающий компонент заранее удаляют из анализируемого раствора (осаждение, экстракция и др.).